资讯中心
中国首个 | 艺妙神州治疗转移性结直肠癌的CAR-T药物获得临床试验批准通知书
2024年10月12日,北京艺妙神州医药科技有限公司(简称“艺妙神州”)宣布,与北京大学肿瘤医院合作开发的用于治疗转移性结直肠癌的全新一代抗肿瘤药物IM96嵌合抗原受体T细胞注射液(IM96 CAR-T细胞注射液,简称“IM96”),获得国家药品监督管理局颁发的药物临床试验批准通知书。这是艺妙神州获批的第6个CAR-T细胞药物临床批件,也是第3个用于治疗实体肿瘤的CAR-T细胞药物临床批件。
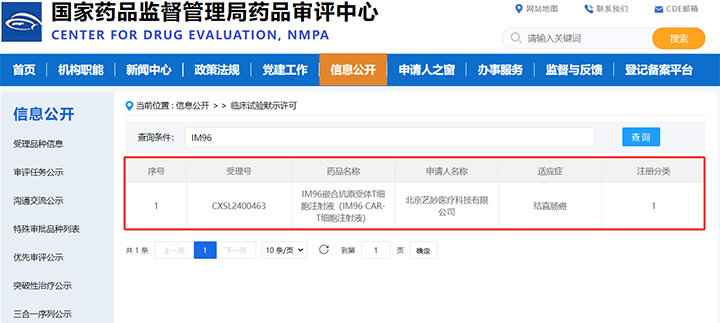
IM96关键亮点
◆ 国内首个:IM96是国内首个获得临床试验批准的用于治疗转移性结直肠癌的CAR-T细胞药物。
◆ 顶尖临床研究单位:IM96临床试验的组长单位为北京大学肿瘤医院,主要研究者(PI)为北京大学肿瘤医院原副院长、消化肿瘤内科主任、I期临床试验病区主任沈琳教授。
◆ 入选2024ASCO:IM96临床前研究数据于今年6月入选美国临床肿瘤学会(ASCO)年会,由北京大学肿瘤医院消化肿瘤内科齐长松教授在大会现场以口头形式发布,获得了学术界和产业界的广泛关注。
◆ 疗效卓越:临床前研究数据显示,IM96的疾病控制率(DCR)达到73.7%,最佳客观缓解率(ORR)达到50%,中位疾病无进展生存期(mPFS)超过10个月。
◆ 安全性高:临床前研究数据显示,IM96仅有5.0%的患者出现神经毒性和≥3级的细胞因子释放综合征(CRS)。
◆ 填补空白:目前治疗转移性结直肠癌在全球范围内还没有任何一款CAR-T药物获批上市,IM96将为这一领域带来突破性进展。
北京大学肿瘤医院沈琳教授表示:祝贺IM96正式获批注册临床!晚期转移性结直肠癌是全球恶性肿瘤治疗的一个重大难题,患者基数巨大,近20年药物治疗进展非常缓慢,大量患者的治疗需求得不到满足。作为一款自主研发的靶向GCC的实体肿瘤CAR-T药物,前期临床研究显示了IM96在治疗晚期转移性结直肠癌中有着显著的临床获益前景。期待尽快启动IM96临床试验,推动产品尽可能早日上市,让更多患者人群获益。
艺妙神州CEO何霆博士表示:此次IM96获批临床,是艺妙神州实体肿瘤CAR-T药物研发历程中重要里程碑事件,也标志着我国CAR-T药物治疗转移性结直肠癌迈入全新的发展阶段,将有望解决该疾病在临床治疗上巨大未满足的需求。下一步,我们将加快IM96的临床试验步伐,尽快推动该药物申报上市,早日惠及中国和全球广大的晚期转移性结直肠癌患者。
结直肠癌是全球范围内最常见的恶性肿瘤之一,全球每年新发病例数超过193万例,死亡病例数超过93万例,发病率和死亡率分别位列全球主要恶性肿瘤的第3位和第2位;中国国家癌症中心(NCC)发布数据显示,2022年中国结直肠癌新发病例数达51.71万例,死亡人数为24万例,是中国第二大高发恶性肿瘤。结直肠癌的治疗一直面临巨大挑战,尤其是对于晚期转移性患者,可供选择的治疗方案极为有限,且疗效欠佳,很难达到满意的治疗效果。
作为艺妙神州自主研发、具有自主知识产权的一款实体瘤CAR-T细胞治疗产品,IM96先后以口头报告形式入选2023ESMO年会和2024ASCO年会等国际肿瘤学术盛会,并凭借其颠覆性的治疗有效性和卓越的安全性数据,获得了国内外业界的广泛关注。此前不久,IM96的临床前研究论文被国际癌症免疫治疗领域顶刊《Journal for ImmunoTherapy of Cancer》杂志接收,将于近期正式发表。



 010-62886890
010-62886890 北京市海淀区玉泉路2号(北区)54幢一层101室
北京市海淀区玉泉路2号(北区)54幢一层101室 office@imunopharm.com
office@imunopharm.com  www.imunopharm.com
www.imunopharm.com